Le méthane océanique participe de façon non-négligeable au réchauffement climatique (Décomposition de clathrates sous-marin de méthane en Arctique)
Décomposition de clathrates sous-marin de méthane en Arctique
Certes , cela reste encore de la science de laboratoire, mais attention il ne faudrait pas que l on comprenne trop tard, ce qui est probablement à l'origine du mecanisme du basculement entre une glaciation et une période chaude.
les facteurs déclenchants semblaient liés , jusqu'à présent uniquement à une variation cyclique de l 'orbite terrestre, cette fois-ci l 'Homme pourrait jouer les apprentis sorcier en donnant l'impulsion. La production de GES échapperait alors à tout contrôle
Le méthane océanique participe de façon non-négligeable au réchauffement climatique
http://www.bulletins-electroniques.com/actualites/60406.htm
Le réchauffement de la température des courants marins en Arctique au cours des 30 dernières années, a déclenché la libération de méthane, puissant gaz à effet de serre, habituellement stocké sous forme d'hydrates de méthane dans les sédiments océaniques profonds.
Les scientifiques du NOCS (National Oceanography Centre Southampton, Centre national d'océanographie de Southampton), en collaboration avec des chercheurs des Universités de Birmingham, du Royal Holloway London et de l'IFM-Geomar en Allemagne, ont révélé que de véritables panaches de bulles de méthane s'échappent d'environs 250 "cheminées" situées entre 150 et 400 mètres de profondeur sur le plancher océanique, au niveau de la marge continentale à l'ouest du Spitzberg occidental [1]. Le relargage dans l'atmosphère de ces bulles de méthane serait "considérable", et contribuerait au changement climatique. Cette découverte ne font que confirmer les différentes prédictions faites lors d'études précédentes.
Les données ont été recueillies par le James Clark Ross, navire royal de recherche, lors d'une mission dirigée par le Natural Environment Research Council (NERC, conseil de recherche pour l'environnement), dans le cadre de l'Année Polaire Internationale [2] (API - en anglais, International Polar Year, IPY). Les bulles de méthane ont été détectées à l'aide d'un sonar et des échantillons d'eau de mer ont été prélevés à différentes profondeurs. Les résultats indiquent que le réchauffement de 1° C du courant marin circulant à l'ouest de Spitzberg au cours des trente dernières années a entraîné la libération de méthane par décomposition de l'hydrate de méthane contenu dans les sédiments sous les fonds marins.
Selon le professeur Tim Minshull, directeur de la Faculté des sciences de la terre et de l'océan à l'Université de Southampton, le but de cette étude était "de déterminer quelle quantité de méthane serait libérée par les couches sédimentaires du plancher océanique si toutefois la température des océans venait à augmenter dans les prochaines années". Les chercheurs ayant pris part à cette étude ne s'attendaient donc pas à "découvrir des éléments indiquant que le processus de relargage du méthane avait déjà commencé."
Il y a une trentaine d'années, l'hydrate de méthane situé sous les fonds marins au alentour de Spitzberg était stable à des profondeurs de 360 mètres. Actuellement, l'hydrate de méthane est stable à des profondeurs supérieures à 400 mètres. Graham Westbrook professeur de géophysique à l'Université de Birmingham affirme que "si ce processus venait à se répandre le long des marges continentales de l'Arctique, des dizaines de mégatonnes de méthane pourrait être libérés dans l'océan chaque année", contribuant d'une part à l'acidification des océans mais également au réchauffement climatique.
L'Hydrate de méthane
Sous des conditions de température et de pression particulières, la glace (H2O) peut piéger des molécules de méthane (CH4), formant une sorte de cage emprisonnant les molécules de méthane. On appelle les composés résultants des hydrates de méthane ou encore des clathrates de méthane. Ces cages cristallines peuvent stocker de très grandes quantités de méthane. L'hydrate de méthane, est donc une "glace" qui contient une quantité énorme de gaz : la fonte de 1 cm3 de cette glace libère jusqu'à 164 cm3 de méthane.
Une importante quantité de matière organique qui se dépose sur les fonds océaniques est incorporée dans les sédiments. Sous l'action des bactéries anaérobies, ces matières organiques se transforment en méthane dans les premières centaines de mètres de la pile sédimentaire. Un volume très important de méthane est ainsi produit. Une partie de ce méthane se combine au molécules d'eau pour former l'hydrate de méthane, dans une fourchette bien définie de température et de pression. Par exemple, un hydrate de méthane qui se trouve dans les sédiments océaniques par 600 mètres de fond à 7° C est stable; il deviendra instable avec une augmentation de température de moins de 1° C. Devenir instable signifie que la glace fond et libère son gaz méthane.
On retrouve les hydrates de méthane en milieu océanique, principalement à la marge des plateaux et sur les talus continentaux, mais aussi à plus faible profondeur dans les régions très froides, comme dans l'Arctique. La marge des plateaux continentaux et les talus constituent une zone privilégiée pour accumuler les hydrates de méthane parce que c'est là que se dépose la plus grande quantité de matières organiques océaniques. On retrouve aussi des hydrates de méthane dans les pergelisols, c'est-à-dire dans cette couche du sol gelée en permanence, même durant les périodes de dégel en surface. Le grand volume de matières organiques terrestres accumulées dans les sols est transformé en méthane biogénique qui, au contact de l'eau est piégé dans des hydrates. Les pressions y sont faibles, mais la température très froide, bien au-dessous de 0° C.
Une déstabilisation massive des hydrates de méthane causée par exemple par une augmentation de 1 ou 2° C de la température des océans, ce qui est tout à fait compatible avec les modèles climatiques actuels, risque de produire une augmentation catastrophique des gaz atmosphériques à effet de serre.
--
[1] Le Spitzberg occidental, à 500 kilomètres à l'est du Groenland, est la plus grande île de l'archipel du même nom dans l'océan Arctique, que l'administration norvégienne appelle Svalbard. Elle a une surface de 37 673 km2 et des dimensions de 280 km de long pour 40 à 225 km de large. Ses couches géologiques et ses fossiles permettent de mieux comprendre la dérive des continents.
[2] L'Année polaire internationale (API - en anglais, International Polar Year, IPY) est un évènement récurrent de collaboration internationale dans le domaine de l'étude des régions polaires (Arctique et Antarctique). Ce "label" a été créé suite au constat selon lequel l'observation scientifique des phénomènes géophysiques et climatologiques ne pouvaient se faire efficacement que par le biais d'une coordination internationale, et non plus seulement par des nations seules. La première édition a été imaginée par Karl Weyprecht, un officier de la marine austro-hongroise qui n'a jamais vu le projet se réaliser de son vivant, en 1882-1883. Les années 2007 à 2009 sont celles de la quatrième édition.
![]()
Code brève
ADIT :
Source :
- Geophysical Research Letters, 6 août 2009 -
Rédacteur :
Mickaël Haustant
en annexe
http://www.ggl.ulaval.ca/personnel/bourque/s3/hydrates.methane.htm
Les trois dernières décennies du XXème siècle ont vu des découvertes étonnantes sur les fonds océaniques : sources chaudes précipitant des sulfures massifs et soutenant une biomasse impressionante, communautés chimiotrophes tirant leur énergie d'évents sulfureux, méthaniques ou amoniaqués, hydrates de gaz, etc. Les hydrates de méthane, entre autres, constituent une réserve énorme d'énergie. On peut prévoir sans trop se tromper que l'Homme tentera d'exploiter cette réserve. Mais saura-t-il le faire sans dommages pour l'environnement planétaire?
On estime aujourd'hui que les hydrates de méthane des fonds océaniques contiennent deux fois plus en équivalent carbone que la totalité des gisements de gaz naturel, de pétrole et de charbon connus mondialememt. Le long de la seule côte sud-est des USA, une zone de 26 000 kilomètres carrés contient 35 Gt (gigatonnes = milliards de tonnes) de carbone, soit 105 fois la consommation de gaz naturel des USA en 1996! La carte qui suit, extraite de Sues, Bohrmann, Greinert et Lausch (Pour la Science, octobre 1999), montre la répartition des gisements connus d'hydrates de méthane dans le monde.
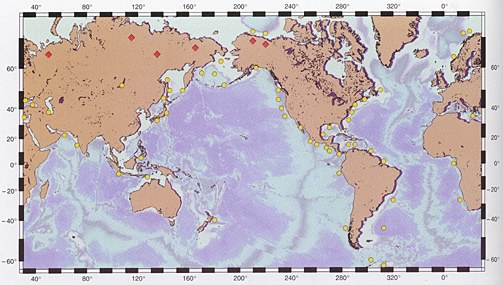
Les points jaunes indiquent les gisements sur les plateaux ou les talus continentaux, les losanges rouges, les gisements dans le pergélisol (sol gelé en permanence).
Qu'est-ce qu'un hydrate de méthane?
Sous des conditions de température et de pression particulières, la glace (H2O) peut piéger des molécules de gaz, formant une sorte de cage emprisonnant les molécules de gaz. On appelle les composés résultants des hydrates de gaz ou encore des clathrates. Les gaz piégés sont variés, dont le dioxyde de carbone (CO2), le sulfure d'hydrogène (H2S) et le méthane (CH4). Ces cages cristallines peuvent stocker de très grandes quantité de gaz. Le cas qui nous intéresse ici est celui de l'hydrate de méthane, une glace qui contient une quantité énorme de gaz: la fonte de 1 centimètre cube de cette glace libère jusqu'à 164 centimètre cubes de méthane!
Origine et stabilité des hydrates de méthane
Une importante quantité de matière organique qui se dépose sur les fonds océaniques est incorporée dans les sédiments. Sous l'action des bactéries anaérobies, ces matières organiques se transforment en méthane dans les premières centaines de mètres de la pile sédimentaire (voir section 3.3.2 - Les combustibles fossiles). Un volume très important de méthane est ainsi produit. Une partie de ce méthane se combine au molécules d'eau pour former l'hydrate de méthane, dans une fourchette bien définie de température et de pression (partie droite du schéma ci-dessous). Vous trouverez des diagrammes plus complets aux liens internet conseillés à la fin de cette page.
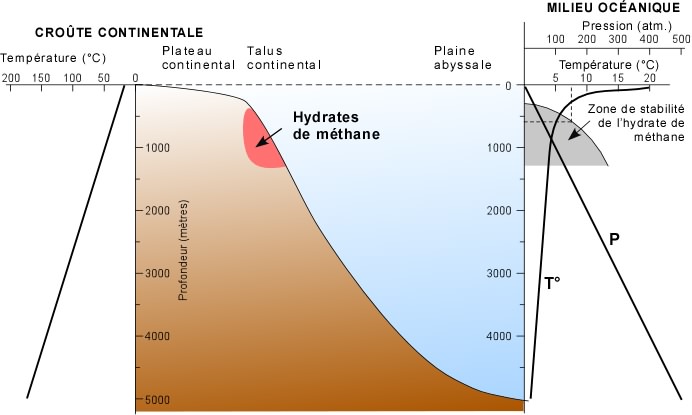
Dans la zone en gris, eau et méthane se combinent pour former un hydrate à l'état de glace, alors qu'à l'extérieur de cette zone, les deux composés sont séparés et se trouvent sous leur propre état, liquide et gaz. C'est dire que l'hydrate de méthane est stable sous les conditions de température et de pression exprimées par la zone en gris, et instable sous les conditions à l'extérieur de cette zone. Par exemple, un hydrate de méthane qui se trouve dans les sédiments océaniques par 600 mètres de fond à 7°C est stable; il deviendra instable avec une augmentation de température de moins de 1°C. Devenir instable signifie que la glace fond et libère son gaz méthane à raison de 164 centimètres cubes de gaz par centimètre de glace.
Où trouve-t-on les hydrates de méthane?
On retrouve les hydrates de méthane en milieu océanique, principalement à la marge des plateaux et sur les talus continentaux (zone en rouge sur le schéma ci-dessus), mais aussi à plus faible profondeur dans les régions très froides, comme dans l'Arctique. La marge des plateaux continentaux et les talus constituent une zone privilégiée pour accumuler les hydrates de méthane parce que c'est là que se dépose la plus grande quantité de matières organiques océaniques. On retrouve aussi des hydrates de méthane dans les pergelisols, c'est-à-dire dans cette couche du sol gelée en permanence, même durant les périodes de dégel en surface. Le grand volume de matières organiques terrestres accumulées dans les sols est transformé en méthane biogénique qui, au contact de l'eau est piégé dans des hydrates. Les pressions y sont faibles, mais la température très froide, bien au-dessous de 0°C.
Une réserve énergétique énorme
À mesure que les réserves conventionnelles d'hydrocarbure s'épuisent, on devra se rabattre sur les réserves dites non-conventionnelles, comme les gisements des régions éloignées et d'exploitation onéreuse, les sables bitumineux et peut-être un jour, les hydrates de méthane. Comme mentionné plus haut, les hydrates de méthane des fonds océaniques constituent une réserve énergétique énorme, ... mais pour l'instant inaccessible. Cette glace méthanique se trouve, soit dans les interstices du sédiment entre les particules de sable ou d'argile cimentant ces derniers ou sous forme de vésicules dans les sédiments, soit en couches de plusieurs millimètres ou centimètres d'épaisseur parallèles aux strates ou en veines les recoupant. Les hydrates de méthane sont donc dispersés dans les sédiments et ne peuvent être exploités par des forages conventionnels; il faudrait plutôt penser à une exploitation massive du sédiment à l'aide de dragues comme on le fait par exemple pour nettoyer les chenaux de navigation des sables et des boues, ou encore d'un système sophistiqué de pompage du sédiment. Mais voilà un énorme risque de déstabiliser rapidement les hydrates et de libérer des quantités considérables de méthane dans l'atmosphère, sans compter les accidents probables associés à ce genre d'exploitation. Il n'en demeure pas moins que l'industrie pétrolière salive à la pensée d'avoir peut-être un jour accès à de telles réserves.
Une bombe écologique en puissance
Une déstabilisation massive des hydrates de méthane causée par exemple par une augmentation de 1 ou 2°C de la température des océans, ce qui est tout à fait compatible avec les modèles climatiques actuels, risque de produire une augmentation catastrophique des gaz atmosphériques à effet de serre. Une telle déstabilisation pourrait aussi causer d'immenses glissements de terrain sous-marins sur le talus continental, entraînant des tsunamis très importants qui affecteraient les populations riveraines. Ce pourrait être là deux des effets catastrophiques du réchauffement climatique actuel causé par une augmentation des gaz atmosphériques à effet de serre. Le méthane eat 21 fois plus efficace que le CO2 comme gaz à effet de serre !

Suess, E., Bohrman, G., Greinert, J. et Lausch, E. Le méthane dans les océans. Pour la Science, No 264 - octobre 1999. Un bon résumé sur le sujet.
http://www.agu.org/pubs/crossref/2009/2009GL039191.shtml
- http://www.ggl.ulaval.ca/personnel/bourque/s3/hydrates.methane.htm60406
